Витамин В12
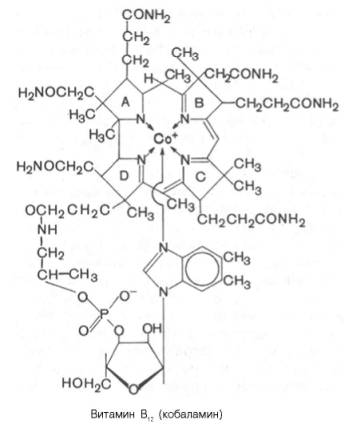
Витамин В12 (кобаламин; антианемический витамин) выделен из печени в кристаллическом виде в 1948 г. Задолго до этого было известно, что в печени животных содержится особое вещество, регулирующее процесс кроветворения и оказывающее лечебный эффект при пернициозной (злокачественной) анемии у людей. Однако только в 1955 г. Д. Ходжкин расшифровала его структуру, включая трехмерную пространственную конфигурацию, главным образом при помощи физических методов исследования (рентгенографическая кристаллография). На основании этих данных, а также результатов изучения химического состава для витамина В12 было предложено следующее строение:
В молекуле витамина В12 центральный атом кобальта соединен с атомами азота четырех восстановленных пиррольных колец, образующих порфириноподобное корриновое ядро, и с атомом азота 5,6-диметил-бензимидазола . Кобальтсодержащая часть молекулы витамина представляет собой планарную (плоскостную) фигуру; по отношению к ней перпендикулярно расположен нуклеотидный лиганд, который, помимо 5,6-диметилбензимидазола, содержит рибозу и остаток фосфата у 3-го атома углерода. Вся структура получила название «кобаламин». Были получены производные витамина В12, содержащие ОН-группу (оксикобаламин), хлор (хлоркобаламин), Н2О (аквакобаламин) и азотистую кислоту (нитрито-кобаламин). Из природных источников были выделены, кроме того, аналоги В12, которые вместо 5,6-диметилбензимидазола содержали 5-окси-бензимидазол, или аденин, 2-метиладенин, гипоксантин и метилгипок-сантин. Все они обладали меньшей биологической активностью, чем ко-баламин. Обычно витамин В12 выделяют из микробной массы или животных тканей, используя растворы, содержащие ионы цианида, которые выполняют роль 6-го лиганда кобальта. Однако цианокобаламин метаболически неактивен. В состав В12-коферментов вместо CN входит остаток 5-дезоксиаденозина или метильная группа.
У человека и животных недостаток витамина В12 приводит к развитию злокачественной макроцитарной, мегалобластической анемии. Помимо изменений кроветворной функции, для авитаминоза В12 специфичны также нарушения деятельности нервной системы и резкое снижение кислотности желудочного сока. Оказалось, что для активного процесса всасывания витамина В12 в тонкой кишке обязательным условием является наличие в желудочном соке особого белка – гастромукопротеина, получившего название внутреннего фактора Касла, который специфически связывает витамин В12 в особый сложный комплекс. Точная роль этого фактора во всасывании В12 не выяснена. Предполагают, что в связанном с этим фактором комплексе витамин В12 поступает в клетки слизистой оболочки подвздошной кишки, затем медленно переходит в кровь портальной системы, а внутренний фактор подвергается гидролизу (распаду). Следует указать, что В12 поступает в кровь портальной системы не в свободном состоянии, а в комплексе с двумя белками, получившими название транскобаламинов I и II, один из которых выполняет функцию депо В12 (I), поскольку он более прочно связывается с витамином В12. Поэтому нарушение синтеза внутреннего фактора в слизистой оболочке желудка приводит к развитию авитаминоза В12 даже при наличии в пище достаточного количества кобаламина. В подобных случаях витамин с лечебной целью обычно вводят парентерально или с пищей, но в сочетании с нейтрализованным желудочным соком, в котором содержится внутренний фактор. Подобный метод лечения эффективен при пернициозной анемии. Это указывает на существование определенной связи между развитием злокачественной анемии у человека и нарушением функций желудка. Можно, вероятно, утверждать, что пернициозная анемия, хотя и является следствием авитаминоза В12, но развивается на фоне органических поражений желудка, приводящих к нарушению синтеза в клетках слизистой оболочки желудка внутреннего фактора Касла, или после тотального удаления желудка хирургическим путем.
Витамин В12 используется в клинике для лечения не только перни-циозной анемии, но и других ее форм – мегалобластических анемий с неврологическими нарушениями, которые обычно не поддаются лечению другими витаминами, в частности фолиевой кислотой.
Биологическая роль. Выявлены ферментные системы, в составе которых в качестве простетической группы участвуют не свободный витамин В12, а так называемые В12-коферменты, или кобамидные коферменты. Последние отличаются тем, что содержат 2 типа лигандов: метильную группу и 5′-дезоксиаденозин. Соответственно различают метилкобаламин СН3-В12 и дезоксиаденозилкобаламин. Превращение свободного витамина В12 в В12-коферменты, протекающее в несколько этапов, осуществляется в организме при участии специфических ферментов в присутствии в качестве кофакторов ФАД, восстановленного НАД, АТФ и глутатиона. В частности, при образовании 5-дезоксикобаламинового кофермента АТФ подвергается необычному распаду с отщеплением три-фосфатного остатка по аналогии еще с одной единственной реакцией синтеза 5-аденозилметионина из метионина и АТФ (см. главу 12). Впервые В12-коферменты были выделены Г. Баркером и сотр. в 1958 г. из микроорганизмов, позже было доказано их существование в тканях животных.
Химические реакции, в которых витамин В12 принимает участие как кофермент, условно делят на 2 группы в соответствии с его химической природой. К первой группе относятся реакции трансметилирования, в которых метилкобаламин выполняет роль промежуточного переносчика метильной группы (реакции синтеза метионина и ацетата).
Синтез метионина требует, помимо гомоцистеина, наличия N 5 -метил-ТГФК и восстановленного ФАД и протекает согласно уравнению:
Фермент, катализирующий эту реакцию, был открыт в печени человека и ряда животных, а также у микроорганизмов. Получены доказательства, что механизм реакции включает перенос метильной группы N 5 -СН3-ТГФК на активный центр фермента с образованием метил-В12-фермента и последующий перенос этой группы на гомоцистеин. Блокирование этой реакции, наблюдаемое при авитаминозе В12, приводит к накоплению N 5 -СН3-ТГФК и соответственно выключению из сферы химических реакций еще одного важного кофермента.
Вторая группа реакций при участии В12-коферментов заключается во внутримолекулярном переносе водорода в реакциях изомеризации. Механизм этих реакций соответствует схеме:
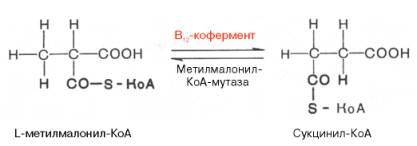
Видно, что протон водорода движется (перемещается) между двумя соседними атомами углерода и не обменивается с протонами воды. Предполагают, что сначала водород от субстрата переносится на 5-дезокси-кобаламин, а затем обратно на субстрат, меняя местоположение. Например, глутаматмутазная реакция (взаимопревращения глутаминовой и β-метиласпарагиновой кислот), метилмалонилмутазная реакция (обратимое превращение метилмалонил-КоА в сукцинил-КоА), глицерол- и диол-дегидратазные реакции, ферментативные реакции восстановления рибо-нуклеотидов до дезоксирибонуклеотидов и др. В организме человека из указанных процессов открыта только реакция изомеризации метил-малонил-КоА в сукцинил-КоА.
Следует подчеркнуть, что реакция изомеризации метилмалонил-КоА требует наличия 5′-дезоксиаденозилкобаламина в качестве кофермента, в то время как реакция метилирования (см. ранее) нуждается в метилкобала-мине. Этими обстоятельствами могут быть объяснены некоторые биохимические симптомы недостаточности витамина В12, в частности метил-малонилацидурия и гомоцистинурия. Кроме того, описаны болезни, обусловленные наследственными дефектами синтеза только дезоксиаденозил-кобаламина или обоих В12-коферментов; в этих случаях даже 1000-кратная доза витамина В12 не оказывала лечебного эффекта. В настоящее время высказывается предположение о более широком участии В12-коферментов в ферментативных реакциях трансметилирования, дезаминирования (например, этаноламиддезаминазная реакция) и др. Предстоит, однако, приложить немало усилий, чтобы выяснить молекулярные механизмы действия витамина В12 на процесс кроветворения. Положительный эффект при лечении пернициозной анемии полусырой печенью обусловлен, как стало известно, наличием витамина В12, хотя следует указать, что большего лечебного эффекта можно добиться при одновременном введении внутреннего фактора слизистой оболочки желудка.
Распространение в природе и суточная потребность. Витамин В12 является единственным витамином, синтез которого осуществляется исключительно микроорганизмами; ни растения, ни ткани животных этой способностью не наделены. Основные источники витамина В12 для человека – мясо, говяжья печень, почки, рыба, молоко, яйца. Главным местом накопления витамина В12 в организме человека является печень, в которой содержится до нескольких миллиграммов витамина. В печень он поступает с животной пищей, в частности с мясом, или синтезируется микрофлорой кишечника при условии доставки с пищей кобальта. Суточная потребность в витамине В12 для взрослого человека составляет около 3 мкг (0,003 мг).
Источник
Витамин B12
Общая информация
Витамины — пищевые факторы, которые присутствуя в небольших количествах в пище, обеспечивают нормальное протекание биохимических и физиологических процессов путем участия в регуляции обмена целостного организма. Нарушения нормального процесса обмена часто связаны с недостаточным поступлением витаминов в организм., полным отсутствием в потребляемой пище или нарушением их всасывания.
В 1849 г. Аддисон впервые описал особую форму анемии, которая в 1868г. была подробно исследована Бирмером и названа пернициозной или злокачественной анемией. Это заболевание, получившее название болезни Аддисона — Бирмера, в течение 75 лет считалось неизлечимым. _Лишь в 1926 г. Минот и Мёрфи успешно применили для его лечения сырую печень. Авторы показали, что у больных, получивших 20 г в день сырой или слегка подваренной печени, наступало заметное улучшение в самочувствии и нормализация картины крови. Ранним признаком улучшения было резкие увеличение количества ретикулоцитов. Очевидно, в печени содержался какой-то фактор, оказывающий целебное действие. Он был назван фактором печени, или антипернициозным фактором. В 1928 г. были начаты работы по извлечению этого фактора из печени. Но прошло еще 20 лет, прежде чем удалось выделить его в чистом виде. Его назвали витамином В12. Столь длительный срок обусловлен крайне низкой концентрацией витамина В12 в печени.
Необходимо упомянуть еще об одном направлении исследований, которое привело к открытию витамина В12. Овцы и крупный рогатый скот, содержащиеся на пастбищах в различных частях света, страдают от болезни, получившей название «сухотка». Животные теряют аппетит и быстро худеют; позже появляется анемия, но только как вторичное явление. Исследования в Австралии показали, что это заболевание связано с недостаткам в почве кобальта и что в кобальте нуждаются бактерии, которые населяют рубец. Их нормальная деятельность весьма существенна для питания жвачных. Оказалось, что продукты жизнедеятельности микробов в рубце, являются богатым источников витамина В12, а также родственных ему факторов. Интерес к проблеме недостаточности кобальта вновь возник с тех пор, как было установлено, что кобальт вводит в структуру молекулы витамина. Установлено, что высокие дозы витамина В12 излечивают овец, страдающих от недостатка кобальта. В 1948г. две независимые группы исследователей в Америке и Англии сообщили о выделение из печени крупного рогатого скота кристаллического активного витамина В12. Ввиду незначительного содержания витамина в печени (1:1000000), получение его из этого источника, являлось дорогостоящим и нецелесообразным. Начались поиски продуцентов витамина среди микроорганизмов.
Первыми были у спешно использованы актиномицеты, которых уже выращивали для производства антибиотиков — стрепромицина и адреномицина. При достаточном содержании в среде кобальта они продуцировали наряду с антибиотиками и витамин В12.
Витамин В12 (кобаламин; антианемический витамин) выделен из печени в кристаллическим виде 1948. Задолго до этого было известно, что в печени животных содержится особое вещество, регулирующее процесс кроветворения и оказывающее лечебный эффекта при пернициозной (злокачественной) анемии у людей. Однако только в 1955 г. D. Ходжкин расшифровала его структуру, включая трехмерную пространственную конфигурацию, главным образом при помощи физических методов исследования (рентгенографическая кристаллография). На основании этих данных а также результатов изучения химического состава для витамина В12 было предложено следующее строение:
В молекуле витамина В12 центральный атом кобальта соединен с атомами азота четырех восстановленных пирролъных колец, образующих дорфириноподобное корриновое ядро, и с атомом азота 5,6 — диметилбензимидазола . Кобальтсодержащая часть молекулы витамина представляет собой планарную (плоскостную) фигуру. Перпендикулярно по отношению к ней расположен нуклеотидный лиганд, который помимо 5,6 — диметилбензимидазола, содержит рибозу и остаток фосфата у третьего атома углерода. Вся структура получила название «кобаламин». Были получены производные витамина В12, содержащие ОН-группу (оксикобаламин), хлор (хлоркобаламин), воду (аквакобаламин) и азотистую кислоту (нитритокщбаламин). Из природных источников были выделены, кроме того, аналоги В12, которые вместо 5.6 — диметилбензимидазола содержали 5-оксибензимидазол, или оденин, 2- метилоденин, гипоксантин и метилгипоксантин. Все они обладали меньшей биологической активностью, чем кобаламин. Обычно витамин В12 выделяют из микробной массы или животных тканей, используя растворы, содержащие ионы цианида, связывающиеся с шестым лигандом кобальта. Однако ценокобаламин метаболически неактивен. В состав В12- коферментов вместо цианидной группировки входит остаток 5-дезоксиаденозина или метилъная группа.
У человека и животных недостаток витамина В12 приводит к развитию злокачественной макроцитарной, мегалобластическрй анемии. Помимо изменения кроветворных функций, для авитаминоза В12 специфичными являются также нарушения деятельности нервной системы и резкое снижение кислотности желудочного сока и содержания особого белка- гастромукопротеина, получившего название внутреннего фактора Касла, который специфический связывает витамин В12 в особый сложный комплекс. Точная роль этого фактора во всасывании В12 не выяснена. Предполагают, что в связанном с этим фактором комплексе витамин В12 поступает в клетки слизистой оболочки подвздошной кишки, а затем медленно переходит в кровь портальной системы. При этом внутренний фактор Касла подвергается гидролизу (распаду).
Следует указать, что В12 поступает в кровь портальной системы не в свободном состоянии, а в комплексе с двумя белками, получившими название транскобаламинов I и II, один из которых выполняет функцию депо В12 (I), поскольку он более прочно связывается с витамином В12 . Поэтому нарушение синтеза внутреннего фактора в слизистой оболочке желудка приводит к развитию авитаминоза В12 даже при наличии в пище достаточного количества кобаламина. В подобных случаях витамин с лечебной целью обычно вводят парентерально или с пищей; но в сочетании с нейтрализованным желудочным соком, в котором содержатся внутренний фактор. Подобный метод лечения эффективен при пернициозной анемии. Это указывает на существование определенной связи между развитием злокачественной анемии у человека и нарушением функций желудка.. Можно, вероятно, утверждать, что пернициозная анемия, хотя и является следствием авитаминоза В12, но развивается на фоне органических поражений желудка с нарушением синтеза внутреннего фактора Касла, или после тотального удаления желудка хирургическим путем.
Витамин В12 используется в клинике для лечения не только пернициозной анемии, но и других ее форм – мегалобластической анемии с неврологическими нарушениями, которые обычно не поддаются лечению другими витаминами, и в частности фолиевой кислотой.
Биологическая роль
Выявлены ферментные системы, в составе которых в качестве простетической группы участвуют не свободный витамин В12, а тат называемые В12- коферменты, или кобамидные коферменты. Последние отличаются тем, что содержат 2 типа лигандов: метилъную группу и 5 — дезоксиаденозин. Соответственно различают метилкобаламин и дезоксиаденозилкобаламин. Превращение свободного витамина В12 в B12 — коферменты, протекающие в несколько этапов, осуществляется в организме при участии специфических ферментов в присутствии в качестве кофакторов ФАД, восстановленного НАД, АТФ и глутатиона. В частности, при образовании 5-дезоксикобаламинового кофермента АТФ подвергается необычному распаду с отщеплением трифосфорного остатка по аналогии еще с одной единственной реакцией синтеза 5 аденозилметионина из метионина и АТФ. Впервые В12- коферменты были выделены в 1958г. из микроорганизмов. Позже было доказано их существование в тканях животных.
Химические реакции, в которых витамин В12 принимает участие как кофермент, условно делят на 2 группы в соответствии с его химический природой. К первой группе относятся реакции трансметилирования, в которых метилкобаламин выполняет роль промежуточного переносчика метилъной группы (реакции синтеза метионина и ацетата).
Синтез метионина требует, помимо гомоцистеина, наличия N5-метил — ТГФК и восстановленного ФАД. Фермент, катализирующий эту реакцию, был открыт в печени человека и ряда животных, а также у микроорганизмов. Получены доказательства, что механизм реакции включает перенос метилъной группы с метил-ТГФК на активный центр фермента с образованием метил-В12.
Вторая группа реакций при участи В12-коферментов заключается во внутримолекулярном переносе водорода в реакциях изомеризации. Предполагают, что сначала водород от субстрата переносится на 5-дезоксикобаламин, а затем обратно на субстрат, меняя местоположение. Например, глутоматмутазная реакция (взаимопревращения глутаминовой и — метиласпарагиновой кислот), метилмалонилмутазная реакция (обратимое превращение метималонил –КоА в сукцинил-КоА), ферментативные реакции восстановления рибонуклеотидов до дезоксирибонуклеотидов и др. В организме человека из указанных процессов открыта только реакция изомеризации метилмалонил-КоА в сукцинил-КоА. Следует подчеркнуть, что реакция изомеризации метилмалонил -КоА требует наличия 5 -дезоксиаденозилкобаламина в качестве кофермепта, в то время как реакция метилирования нуждается в метилкобаламине. Этими обстоятельствами могут быть объяснены некоторые биохимические симптомы недостаточности витамина B12, в частности метилонилацидурия и гомоцистинурия. Кроме того, описаны болезни, обусловленные наследственными дефектами синтеза только дезоксиаденозилкобаламина или обоих аналогов витамина В12. При этом введение витамина В12 не оказывало лечебного эффекта. В настоящее время высказывается предположение о более широком участии В12 в процессе кроветворения. Положительный эффект при лечении пернициозной анемии полусырой печенью обусловлен, как стало известно, наличием витамина В12, хотя следует указать, что большего лечебного эффекта можно добиться при одновременном введении внутреннего фактора слизистой оболочки желудка.
Распространение в природе и суточная потребность
Витамин В12 является единственным витамином, синтез которого осуществляется исключительно микроорганизмами; ни растения, ни ткани животных этой особенностью не наделены. Основные источники витамина В12 для человека — мясо, говяжья печень, почки, рыба, молоко, яйца. Главным местом накопления витамина В12 в организме человека является печень, в которой содержится до нескольких миллиграммов витамина. В печень он поступает с животной нищей, в частности с мясом, или синтезируется микрофлорой кишечника при условии доставки с пищей кобальта. Суточная потребность в витамине В12 для взрослого человека составляет около З мкг (0,003 мг).
Внутримышечное введение столь малого количества витамина В12, как З-6 мкг, достаточно чтобы вызвать ремиссию у пациента, больного пернициозной анемией, а доза 1мкг в день достаточна для поддержания результатов лечения (для этой цели чаще всего вводят аквокобаламин: один раз в две недели.) Необходимая пероралъная доза значительно (в 2-50 раз) больше. Обычно не составляет никакого труда покрыть эту потребность за счет обычной пищи. Витамин Ф12 отличается тем, что он синтезируется главным образом бактериями, а большинство растений содержат его в небольшом количестве или не содержат вообще. Поэтому симптомы пернициозной анемии иногда наблюдаются у строгих вегетарианцев.
К пернициозной анемии обычно приводит не отсутствие в рационе витамина В12, а плохое его всасывание. Всасывание зависит от наличия так называемого «внутреннего» фактора -мукопротеида (или мукопротеидов ), вырабатываемого слизистой желудка. Люди, больные пернициозной анемией, часто имеют наследственную предрасположенность к пониженному синтезу внутреннего фактора. Гастроэктомия ( при которой снижается количество синтезируемого внутреннего фактора) и заражение широким лентецом (который конкурирует за имеющийся витамин В12 и нарушает его всасывание), также могут спровоцировать болезнь. Нормальный уровень витамина В12 в крови составляет 0,2 нМ или немного выше. Однако у вегетарианцев этот уровень может опускаться ниже половины этой величины. Недостаточность фолиевой кислоты также может вызывать мегалобластическую анемию, а большой избыток фолиевой кислоты может в некоторой степени уменьшить анемию у пациентов, больных злокачественным малокровием. Опасение, что потребление больших количеств фолиевой кислоты помешать диагностике пернициозной анемии и в тоже время вызвать серьезные психические расстройства, привело к тому, что в 1960 г. в США специальное агентство, занимающееся вопросами, связанными с пищевыми продуктами и лекарственными препаратами (Food and Drug Agency), постановило, что содержание фолиевой кислоты в таблетках поливитаминных препаратов не должно превышать 25 мг.
Проявление недостаточности витамина В12
Гипо- и авитаминоз В12 у человека может развиваться в следствие как экзогенной недостаточности содержания витамина в пище, так и различных условий эндогенного порядка, сопровождающихся нарушением всасывания и усвоения витамина. Различают две формы эндогенного авитаминоза: гастрогенный, причиной которого является отсутствие или недостаточность внутреннего фактора, что приводит к нарушению использования пищевого витамина В12, и энтерогенный, развивающийся в следствие расстройства всасывания витамина В12 в кишечнике (наличие широкого лентеца, значительное разрушение витамина патологический кишечной микрофлорой и т.д.).
Гастрогенный В12-авитаминоз лежит в основе болезни Аддисона –Бирмера (синонимы: пернициозная, злокачественная анемия), а также некоторых форм симптоматических мегалобластических анемий после тотальной (субтотальной) резекции желудка. Пернициозной анемией заболевают преимущественно в зрелом возрасте (30-50 лет.) Заболевание характеризуется нарушением со стороны кроветворной, нервной, пищеварительной и сердечно — сосудистой систем. Со стороны нервной системы выявляются симптомы дегенерации и склероза главным образом задних, а также боковых столбов спинного мозга (фуникулярный миелоз), что характеризуется снижением , а иногда отсутствием рефлексов, появлением патологических рефлексов, атаксией, нарушением глубокой и затем поверхностной чувствительности (ощущение ползания мурашек, онемение и др.) Позднее нарушаются функции сфинктера мочевого пузыря и прямой кишки.
Наиболее характерным признаком при болезни Аддисона- Бирмера является анемия гиперхромного типа: в крови появляются большие богатые гемоглобином эритроциты — макроциты и мегалоциты. Последние, достигая 12-14 мкм и больше, являются конечным продуктом мегалобластического (эмбрионального) кроветворения.
Другой разновидностью гастрогенного В12-авитаминоза являются анемии, развивающиеся после тотальной или субтотальной резекции желудка. Чаще всего такие анемии являются железодефицитными, но в далеко зашедших случаях могут быть мегалобластическими. Развитие анемии вследствие частичного или полного удаления желудка наблюдается в различные сроки (от 1года до 12 лет после операции) и связано с прекращением выработки внутреннего фактора в желудке и нарушением компенсаторных механизмов со стороны кишечника.
Среди форм энтерогенного В12- авитаминоза наибольшее значение в практике имеет мегалобластическая анемия у носителей широкого лентеца, которая сопровождается типичными для болезни Аддисона-Бирмера изменениями кроветворения и нарушениями нервной системы. При исследовании с помощью витамина В12, меченного кобальтом-60, установлено, что лентец поглощает значительное количество вводимого витамина. По — видимому, витамин В12 необходим для роста паразита, поскольку наибольшее количество метки обнаруживалось в проксимальной части тела гельминта, т.е. в месте образования проглоттидов. Широкий лентец поглощает витамин В12 из кишечника. Однако далеко не каждое глистоносительство ведет к развитию пернициозной анемии. В12-авитаминоз может наступить лишь при количественно недостаточном поступлении витамина, необходимого для хозяина и паразита, при исключительно большом поглощении его паразитом, повышенной потребности и пониженной способности хозяина к использованию витамина. Экзогенный В12-авитаминоз, возникающий в результате недостаточного поступления витамина В12 с пищей, лежит в основе анемии беременных, вегетарианцев, макроцитарных гиперхромных анемий.
Гиповитаминоз витамина В12
Дефицит витамина В12приводит к синтезу дефектной ДНК, которая присутствует в каждой клетке. Наиболее выраженные изменения развиваются в пролиферирующих, делящихся клетках, например, в клетках костного мозга, полости рта, языка и желудочно-кишечного тракта, что ведет к развитию мегалобластического типа кроветворения, глоссита, стоматита и кишечной мальабсорбции. Патологическая митотическая активность выявляется в предшественниках лепкоцитов и тромбоцитов, поэтому макроцитарная анемия часто сопровождается появлением в периферической крови гигантских тромбоцитов и полиморфноядерных лейкоцитов с гиперсегментированными ядрами. Мегалобласты отличаются более коротким жизненным циклом и рано подвергаются гемолизу, что иногда сопровождается желтухой. Короткий жизненный цикл характерен и для других мегалобластически измененных клеток, например, клеток желудочно-кишечного тракта. При дефиците витамина В12 происходят дегенеративные процессы в миелиновой оболочке периферических нервов, спинном и головном мозге. У части больных возможны изменения психики: беспокойство, дезориентация, депрессия, психозы.
Можно выделить несколько причин развития авитаминоза В12:
- недостаточное поступление витамина с пищей;
- нарушение всасывания кобаламинов;
- врожденные нарушения метаболизма кобаламинов.
Недостаточное поступление витамина В12 с пищей редко приводит клиническим проявлением дефицита. Низкое содержание витамина в женском молоке может быть причиной развития мегалобластической анемии у младенцев. Нарушение всасывания может быть связано с такими заболеваниями; как хронический панкреатит, болезнь Крона, резекция желудка или большой части тонкой кишки, опухоль желудка. Мегалобластная анемия вследствие этих причин чаще наблюдается у взрослых. У детей чаще встречаются врожденная недостаточность или функциональная неполноценность внутреннего фактора. Среди других причин мальабсорбции витамина В12, встречающихся как у детей, так и y взрослых, можно назвать инвазию широким лентецом и тропическую болезнь спру. При целиакии чаще бывает гипохромная микроцитарная анемия, но из-за нарушения всасывания витамина В12 и фолатов может развиваться и мегалобластная анемия. Дефицит витамина В12 выявляется и при муковисцидозе, хотя анемия при этом возникает редко.
Нарушения метаболизма витамина В12 наблюдаются у младенцев, страдающих генетическими обусловленными дефектами ферментов, необходимых для превращения витамина В12 в кофермент, или низким уровнем плазменного белка-переносчика. Развивающаяся при этом мегабластная анемия проявляется уже в первые недели или месяцы жизни и характеризуется нормальным или чуть сниженным уровнем витамина В12 в крови при значительной диспропорции в концентрации индивидуальных форм кобаламинов. В отличие от нее при анемии, развивающейся в результате нарушений всасывания, всегда выявляется низкий уровень витамина В12.
Еще одним достаточно редким проявлением генетического нарушения метаболизма витамина В12 у детей является метилмалоновая ацидурия. Клинически это состояние проявляется значительным отставанием ребенка в весе, сниженной толерантностью к белкам с эпизодами кетоацидоза, интермитирующей гипогликемией, гипераммониемией и гиперглицинемией, высоким содержанием метилмалоновой кислоты в моче. Заболевание не сопровождается развитием мегалобластной анемии.
Клиника В12 – дефицитной или пернициозной анемии
Малокровие, вызванное эндогенной недостаточностью витамина B12 в результате атрофических изменений слизистой оболочки фундального отдела желудка, сопровождающаяся нарушением выработки антианемического фактора Касла, называется пернициозной анемией или болезнью Аддисона-Бирмера.
Симптомы и течение
Характерна триада симптомов: нарушения со стороны пищеварительного тракта (ахилия, глоссит — ощущение «ошпаренного языка»), нарушение со стороны нервной системы (мышечные боли, судороги, нарушения глубокой чувствительности) и изменения крови (гиперхромная анемия). Больные бледны, кожа и слизистая оболочка с желтушным оттенком, общая слабость. Болезнь протечет хронически, с периодами улучшения и ухудшения. В период тяжелого рецидива может развиться пернициозная кома: потеря сознания, отдышка, рвота, непроизвольное мочеиспускание, падение температуры и артериального давления.
Дo 1926 г. это заболевание было неизлечимым и обычно кончалось смертью. При этом заболевании в организме вырабатываются аномально большие, недоразвитые и нестойкие эритроциты, общее количество которые значительно снижается (от 2 до 6 раз). Пo-видимому, блокируется митоз в костном мозге и подавляется синтез ДНК. Заболевание поражает также и другие быстро растущие ткани, например слизистую оболочку желудка (в результате прекращается секреция соляной кислоты) и нервные ткани. Часто наблюдается демиелизация центральной нервной системы с нарушением координации движении (атаксия) и психическими расстройствами.
Химия и биохимия витамина В12
Цианкобаламин относится к классу корриноидов — производных коррина, структура которого родственна порфирину. Однако, наряду с близостью их структур, имеются два важных химических различия между этими макроциклами. В то время как порфирин содержит систему из 12 сопряженных двойных связей, коррин состоит из частично восстановленных пиррольных (пирролиновых) гетероциклов. Корриновое кольцо содержит 6 двойных связей, входящих в состав линейной сопряженной системы, включающей 12 из 15 атомов, составляющих внутренний контур макроцикла. Корриновое кольцо сужено по сравнению с порфириновым. Если в порфирине каждая пара пиррольных колец отделена метановыми мостиками, то в коррине кольца А и D соединены непосредственно связью между альфа-положениями. Поэтому внутренний контур корринового макроцикла содержит на один атом углерода меньше, чем порфириновый.
В соответствии с номенклатурой корриноидов, утвержденной в 1975 г. Международной комиссией по биохимической номенклатуре, органический экваториальный лиганд, состоящий из четырех восстановленных пиррольных колец с атомом кобальта в центре, назван коррином, а соединения его содержащие –корриноидами.
Витамин В12 кристаллизуется в виде темно-красных игл или призм. Цвет варьирует от величины кристаллов. Кристаллографические измерения показывают, что кристаллы относятся к орторомбической системе и имеют призматическую форму. При кристаллизации из водного раствора и из смеси воды с ацетоном они содержат значительное, но изменчивое количество непрочно связанной кристаллизационной воды. Ее можно удалить нагреванием при пониженном давлении, причем кристаллы не теряют своей формы. После этого обезвоженный материал может снова поглощать влагу из атмосферного воздуха в количестве 10-12%; это и есть тот продукт, который обычно выпускается под названием витамина В12 и зарегистрирован в фармакопеях Англии и США. Витамин В12 довольно хорошо растворим в воде (около 1,2% при комнатной температуре), а также в низших спиртах, в низших алифатических кислотах и в фенолах, но нерастворим во многих других органических жидкостях. Он практически не растворяется в пиридине и других третичных аминах, но растворим в некоторых жидких или расплавленных амидах, например в ацетамиде и диметилформамиде. Витамин является левовращающим веществом, но интенсивная, окраска затрудняет измерение оптического вращения. Витамин В12 обладает диамагнитными свойствами, что указывает на трехвалентное состояние кобальта.
Обычно витамин выделяют из микробной массы или животных тканей, используя растворы, содержащие цианид-ионы, играющие роль шестого лиганда кобальта. Однако сам цианкобаламин метаболически не активен. В состав ферментов входит соединение, в котором цианогруппа замещена остатком 5-дезоксиаденозина или метальным радикалом.
Механизм действия
Когда биохимики привыкли к мысли, что витамин В12 не просто специфический антипернициозный фактор, а один из витаминов группы В, они стали предполагать, что он подобно другим водорастворимым витаминам окажется кофактором по крайней мере в одной ферментной системе. Но вопреки ожиданию функции, приписываемые витамину В12 различными исследователями, оказались столь многочисленными и разнообразными, что трудно было представить себе, как все они могли быть связаны с такой ролью кофактора. Поэтому стали искать его основную функцию. Например, казалось вероятным, что он каким-то образом ответствен за поддержание сульфгидрильных соединений в восстановленном реактивном состоянии. Он мог бы, скажем, «активировать» различные SH-ферменты, препятствуя их окислению в неактивные S-S-формы. Или если он связан с синтезом белка, он был бы необходим для синтеза белковой части (апофермента) ряда ферментов.
Позднейшие исследования, особенно с применением изотопов, поставили под сомнение некоторые из приписываемых витамину В12 функций и выдвинули на первый план другие.
Обмен жиров и каротина
Благотворное действие витамина В12 на обмен жиров у животных приписывают поддержанию кофермента А в активном восстановленном состоянии. У крысят, получающих рацион с недостатком витамина В12, организм не способен синтезировать жиры, а у взрослых крыс нарушается использование жиров пищи так, что животные становятся тучными в результате избыточного накопления жира. Полагают, что этот эффект лишь частично объясняется, действием витамина B12 на синтез метионина, в результате которого, в свою очередь, увеличивается количество липотропных веществ — холина и бетаина. Установлено, что витамин В12 повышает всасывание каротина или превращение его в витамин А у крыс (на что указывает повышенное накопление последнего в печени); хотя и не влияет на накопление готового витамина А. Механизм этого действия еще неясен.
Витамин В12 и окислительно-востановительные процессы
Утверждали, что витамин В12 помимо действия на сульфгидрильные соединения поддерживает в восстановленном состоянии другие важные вещества. Так, было установлено, что в плазме больных пернициозной анемией содержание аскорбиновой кислоты понижено; кроме того, при инъекции таким больным аскорбиновой кислоты она быстро окисляется в дегидроаскорбиновую. После лечения витамином В12 эти явления исчезают, а инъекции аскорбиновой кислоты ведут к повышению ее концентрации в плазме. В тоже время в печени крыс с недостаточностью витамина В12 общее содержание дифосфопиридиннуклеотида повышено, но количество его восстановленной формы (ДПН-Н) понижено. Ненормально высокое отношение ДПН/ДПН-Н снижалось вдвое после введения витамина В12.
Было высказано предположение, что витамин В12 способен играть роль восстановителя, когда его трехвалентный кобальт восстановлен до двухвалентного состояния. Однако нужны сильные восстановители, чтобы вызвать эту реакцию, которая в присутствии атмосферного кислорода идет в обратном направлении. Предположение о том, что соединение с белком могло бы сдвинуть окислительно-восстановительный потенциал в область физиологических величин, не вполне убедительно, так как способность связывать белок после восстановления, возможно, утрачивается.
Биосинтез метионина и серина
Метилкобаламин участвует в реакциях синтеза метионина в качестве кофактора. Заключительный этап синтеза метионина у бактерий, грибов, высших растений и животных состоит в переносе метильной группы от СНз-ТГФК к сульфгидрильной группе гомоцистеина.
Существует два типа ферментов, осуществляющих синтез метионина — первый, независимый от кобаламинов, может использовать в качестве донора метальной группы только триглутаматную форму СНз-ТГФК. Второй тип ферментов, зависимый от кобаламиновых кофакторов, может использовать как моно-, так и триглутаматную форму СНз-ТГФК. Для активации ферментов второго типа, кроме того, требуется S-аденозилметионин (S-AdoMet). Последний необходим для первоначального метилирования кобаламина.
Ранние эксперименты с изучением роста цыплят и крыс также показали, что витамин В12 снижает потребность в метионине, особенно при введении гомоцистеина. Сначала это было истолковано как действие витамина на трансметилирование, т. е. на передачу лабильной метальной группы от холина или бетаина к гомоцистеину с образованием метионина. Точно так же витамин В12 может, по крайней мере частично, заменять холин для цыплят, крыс и поросят-сосунков. Ряд исследований (некоторые из них с использованием 14С) показал, что витамин В12 не оказывает никакого влияния на трансметилирование, но участвует в прямом синтезе лабильной метильной группы из более окисленных предшественников — таких, как формиат, альфа-углерод глицина или бета-углерод серина.
Витамину В12 приписывали участие в восстановлении гомоцистина до гомоцистеина — акцептора метильной группы. Однако последующие опыты с мечеными аминокислотами показали, что витамин, возможно, не нужен для этого восстановления. Какое-то производное фолиевой кислоты, несомненно, участвует в самом переносе радикала с одним углеродным атомом. Тогда единственная функция, остающаяся для витамина B12, состоит в восстановлении этой группы в метильную группу метионина — если только витамин не действует лишь косвенным образом, способствуя, например, синтезу ферментов. Во всяком случае, синтез метионина не может быть единственной биохимической функцией витамина В12 у высших животных, так как они гибнут от его недостаточности даже при большом количестве метионина и холина в пище.
Синтез нуклеиновых кислот
С самого начала работ в данной области считали почти несомненным, что витамин В12 стимулирует синтез дезоксирибонуклеиновой и, вероятно, рибонуклеиновой кислот. Молочнокислые бактерии, используемые для определения витамина В12, почти так же хорошо растут при замене его большими количествами тимидина или других дезоксирибонуклеозидов. Проще всего это можно объяснить тем, что витамин В12 участвует в каком-то этапе синтеза ДНК. Выяснилось, что действие витамина связано с синтезом дезоксирибозного компонента ДНК. Некоторые ученые полагают, что у некоторых бактерий витамин В12 стимулирует синтез не только ДНК, но и РНК.
Однако другие микроорганизмы, нуждающиеся в витамине В12, не способны расти на дезоксирибозидах, и нет данных о том, что у этих видов витамин контролирует синтез ДНК. У мутанта Е. coli равномерно меченный уридин превращался в тимин не только в присутствии витамина В12, но и в присутствии метионина; кроме того, у него не наблюдалось превращения меченой рибозы в дезоксирибозид. Тем не менее была тенденция переносить выводы из опытов с молочнокислыми бактериями также и на высших животных, включая человека. Этому способствовал факт энергичной регенерации эритроцитов и роста эпителия языка после лечения рецидивов пернициознои анемии цианкобаламином. Здесь действительно должен происходить быстрый синтез нуклеиновых кислот, но возможно, что этот процесс подавляется при недостаточности витамина, так как для пролиферации клеток необходимы и другие компоненты. Кроме того, активность костного мозга при пернициознои анемии отнюдь не подавлена. В самом деле, кругооборот компонентов гема примерно втрое превышает нормальный уровень, но большая часть этой активности бесполезна для образования новых эритроцитов. Ряд исследователей отмечает пониженное содержание ДНК, РНК или обеих нуклеиновых кислот в организме животных при авитаминозе В12. Было установлено, что в мегалобластическом костном мозге человека отношение урацил/тимин и соответственно отношение РНК/ДНК значительно выше нормального. После лечения витамином В12 или фолиевой кислотой обе величины быстро уменьшались до нормы. Предложенное объяснение состояло в том, что витамин В12 катализирует синтез компонента ДНК – тимина. Метилирование урацила с образованием тимина формально аналогично метилированию гомоцистеина с образованием метионина -реакции, которую, как известно, стимулирует витамин В12.
Позже в опытах с изотопами стали искать более прямых данных. Исследовали, например, влияние витамина В12 на включение радиоактивного фосфора в нуклеиновые кислоты. Витамин В12 стимулировал включение его во фракцию ДНК кишечника и селезенки, но не печени и в то же время не влиял на радиоактивность РНК.
Белковый обмен
Очевидно, что благодаря своему влиянию на синтез метионина витамин В12 оказывает какое-то действие на белковый обмен. Например, можно ожидать, что цианкобаламин будет улучшать использование белка из рационов, в которых этой аминокислоты недостаточно. Таким образом объясняли некоторые из отмеченных выше благотворных эффектов витамина. Значительную прибавку в весе тела, даже если она связана с увеличением количества не только жира (как часто бывает), но и белка, обычно можно объяснить просто повышенным потреблением пищи животными, получающими витамин В12. Не было обнаружено никакого влияния витамина В12 на баланс азота и эффективность использования белков у крыс. Различные исследования, однако, указывали на более прямую роль этого витамина в синтезе белка. Так, было установлено, что у крыс с гипертиреозом (гиперфункцией щитовидной железы) витамин В12 способствует удержанию азота. У кур при недостаточности витамина В12 концентрация аминокислот в крови повышена, а белков в плазме – понижена. У человека также показано обратное отношение между концентрациями аминокислот и витамина В12 в крови, что объясняется стимулирующим действием витамина на синтез белков. Сообщается об избыточном выведении с мочой аминокислот, особенно лизина (но также и таурина) при обострении пернициозной анемии и дегенерации спинного мозга. Нарушение нормального обмена тирозина и триптофана могло бы вести к избыточному выделению фенольных веществ, тоже отмеченному при пернициозной анемии, и, возможно, к образованию токсичных веществ, вызывающих гемолиз, которым иногда сопровождается это заболевание. Все эти обменные нарушения быстро исчезают после введения витамина В12. Было отмечено, что при дегенерации спинного мозга, часто сопровождающей пернициозную анемию, поражаются некоторые крупные аксоны, нормальное состояние которых поддерживается быстрым обновлением белка. Поэтому исследователи предположили, что витамин В12, специфически излечивающий это состояние, косвенным образом контролирует синтез белка. Полагая, что прямое действие витамина направлено на синтез нуклеиновых кислот, они связали свое предположение с гипотезой о том, что РНК служит «шаблоном» для синтеза белка. С другой стороны, их данные было бы логичнее истолковать в пользу прямого действия витамина В12 на синтез белков.
Изучалось влияние витамина В12 на включение меченого серина или меченой глюкозы в белки печени и в некоторые отдельные аминокислоты у свиней и крыс. Во всех опытах полученные величины были заметно ниже у животных с авитаминозом. Исследователи приводят соображения в пользу того, что это не было следствием одного лишь пониженного потребления пищи. Данные наблюдения были дополнены исследованиями, проведенными in vitro на препаратах микросом из печени и селезенки нормальных крыс и крыс с авитаминозом. Как показано, между этими группами животных обнаружились большие различия во включении меченых аминокислот. Кроме того, при добавлении витамина B12 к препаратам микросом, полученных от животных с авитаминозом, включение аминокислот заметно возрастало.
Ученые пошли дальше и показали, что в надосадочной жидкости после центрифугирования микросом печени, находится содержащий витамин В12 «рН5-фермент», катализирующий включение меченых аминокислот в белок. Интересно было бы выяснить, не обладает ли ферментативной активностью комплекс витамина В12 с пептидом, выделенный ранее из печени. Позднее было показано, что «рН5-фермент» содержит большую часть витамина В12, первоначально находившегося в микросомах печени. Этот фермент подвергли дальнейшему фракционированию. Он, по-видимому, катализировал как активацию аминокислот аденозинтрифосфатом, так и их последующее включение в белковую фракцию микросом. Кроме того, оба процесса подавлялись антагонистами витамина В12, содержащими остаток анилида вместо одной из амидных групп. Исследователи высказали гипотезу, что комплекс витамин В12-фермент действует как активатор-переносчик: он переносит аминокислоты (после активации их карбоксильных групп аденозинтрифосфатом) на «шаблон», возможно, путем транспептидирования, в котором участвуют 6 карбоксамидных групп молекулы витамина. Некоторые ученые приводят соображения, позволяющие предполагать, что некоторые из карбоксамидных групп являются биохимически активными частями молекулы. Контролем синтеза апоферментов можно было бы объяснить влияние витамина В12 на ряд, казалось бы, не связанных между собой ферментных систем. В пользу этого можно привести и другие данные. Различные исследователи утверждали, что недостаточность витамина В12 у крыс ведет к уменьшению содержания в их печени некоторых ферментов, а именно трансметилазы, рибонуклеазы, цитохромоксидазы и различных дегидрогеназ. Другие авторы установили, что при отсутствии витамина В12 не происходит регенерации ткани печени после частичной гепатэктомии.
Некоторые В12-зависимые ферменты
В12-коферменты многочисленны и различны. Они отличаются тем, что содержат два типа лигандов: метальную группу и 5″-дезоксиаденозин.
Превращение свободного витамина В12 в кофермент происходит в присутствии специфических ферментов и при участии в качестве кофакторов ФАД, восстановленного НАД, АТФ и глутатиона.
При образовании 5-дезоксикобаламинового кофермента АТФ подвергается необычному распаду с отщеплением трифосфатного остатка по аналогии с реакцией синтеза 5-аденозилметионина из метионина и АТФ.
Химические реакции с участием В12-коферментов подразделяют на две группы: реакции трансметилирования и изомеризации. В реакциях первой группы коферменты играют роль промежуточных переносчиков метильной группы. К таким реакциям относятся, например, синтезы метионина и ацетата. Гомоцистеин под воздействием метилкобаламина и тетрагидроилглутаматметил-трансферазы в присутствии восстановленного ФАД и N5-СНз-ТГФК превращается в метионин. Метальная группа N5-СНз-ТГФК переносится вначале на активный центр фермента, затем на гомоцистеин. Ко второй группе реакций относится изомеризация L-метилмалонил-КоА в сукцинил-КоА.
Диолдегидратаза
Приведем вначале важнейшие данные, полученные за последние годы при исследовании диолдегидратазы, т. е. фермента, катализирующего превращение этандиола-1,2, и пропандиола-1,2, соответственно, в ацетальдегид и пропионовый альдегиды. Оказалось, что один и тот же фермент способен катализировать превращение и этандиола-1,2 и пропандиола-1,2 в соответствующие альдегиды. Примечательной особенностью этого фермента, как и всех остальных аденозилкобаламин-зависимых ферментов, явилось то, что окончание реакции сопровождается деструкцией и высвобождением кофермента из фермент-коферментного комплекса.
Диолдегидратаза представляет собой белок с мол. массой 250000 с единственным активным центром содержащим аденозилкобаламин. Хроматография позволяет разделить фермент на две субъединицы с разными молекулярными массами. Каждая из субъединиц неактивна, рекомбинация их приводит к восстановлению активности. Весьма важным и, по-видимому, общим свойством всех аденозилкобаламин-ферментов, является чувствительность диолдегидратазы к сульфгидрильным ингибиторам. Образование тройного ферментного комплекса (апофермент-АденозилКобаламин-пропандиол-1,2) полностью защищает фермент от действия ртутьсодержащих ингибиторов. Это позволяет утверждать, что HS-rpynna (или группы) фермента может иметь большое значение для проявления биокаталитической активности. Важно подчеркнуть, что защищающим действием, помимо аденозилкобаламина, обладают и другие Кобаламины (CN-Кобаламин, метилкобаламин), введение которых в ферментный комплекс вместо кофермента приводит к его инактивации. Тем не менее расщепление такого комплекса после обработки SH-соединением и последующая реконструкция с аденозилкобаламином вновь восстанавливает активность. Изучение химической модификации этого фермента выявило большое значение различных аминокислотных остатков в активном центре фермента. Так оказалось, что один остаток аргинина на моль фермента является необходимым для проявления каталитической активности диолдегидратазы. Наконец, недавно было продемонстрировано значение другой основной аминокислоты — лизина для проявления ферментативной активности. Остаток лизина, важный для обеспечения активной олигомерной структуры фермента и связывания аденозилкобаламина, локализован в низкомолекулярной субъединице. Остатки основных аминокислот обеспечивают ионное взаимодействие между субъединицами.
Глицеролдегидратаза
Другой фермент, катализирующий превращения вицинальных гликолей в альдегиды — глицеролдегидратаза или глицеролгидролиаза ответственен за изомеризацию глицерина в бета-оксипропионовый альдегид и продуцируется как некоторыми штаммами Klebsiella p., так и Propionibactereciae. Кофакторами, необходимыми для проявления активности глицеролдегидратазы, являются аденозилкобаламин и К+. Очистка фермента из Кlebsiella. р. привела к выделению ферментного комплекса с мол. массой 188000, содержащего две субъединицы разного размера и 1 моль аденозилкобаламина на 1 моль фермента. Меньшая субъединица с мол. массой 22 000 в свою очередь распадается на два белка с мол. массой около 12 000. Самосборка субъединиц в ферментном комплексе промотируется субстратом — глицерином, аденозилкобаламином и ионом К+. Интересно, что ион Na+ ингибирует активность фермента и ни одна из субъединиц по отдельности не способна связывать аденозилкобаламин. Аналогично диолдегидратазе, глицеролдегидратаза ингибируется сульфгидрильными ингибиторами, причем в опытах с обработкой субъединиц и последующей сборкой было показано, что меньшая субъединица после обработки еще сохраняет 25% от первоначальной активности, в то время как большая полностью ее теряет.
Этаноламин-аммиак-лиаза
Фермент, осуществляющий превращение этаноламина в ацетальдегид и аммиак — этаноламин-аммиак-лиаза — был описан в 1965 г., очищен и выделен в гомогенном состоянии в 1968 г.
Итоги изучения фермента можно суммировать следующим образом: оказалось, что, в отличие от диолдегидратазы, единственным субстратом этаноламин-аммиак-лиазы является этаноламин. Позднее было выяснено, что L-2-аминопропанол также может превращаться в пропионовый альдегид и аммиак. Однако это превращение сопровождается необратимым расщеплением кофермента.
Фермент представляет собой довольно большой белок с мол. массой 520000. В пятимолярном растворе гуанидин-HCl он диссоциирует — на субъединицы с мол. массой 50000. Показано, что фермент содержит два независимых активных центра. Подобно диолдегидратазе фермент активируется одновалентными катионами К+ и NH4+ и ингибируется сульфгидрильными ингибиторами.
Аденозилкобаламин-зависимые мутазы
Следующую группу Аденозилкобаламин-ферментов, составляют мутазы, катализирующие перегруппировки углеродного скелета и приводящие к обратимым превращениям субстратов с разветвленной цепью в соединения с прямой цепью. Среди этих ферментов хорошо изучены два — глутаматмутаза и метилмалонил-СоА-мутаза.
Глутаматмутаза
Фермент, катализирующий превращение L-глутамата в L-трео-бета-метиласпартат, был выделен, из Clostridium tetanomorphum. Показано, что многочисленные фотосинтезирующие микроорганизмы также содержат глутаматмутазу. Фермент, кроме аденозилкобаламина, нуждается в SH-соединении, однако, в отличие от диолдегидратаз и других аналогичных ферментов, для проявления каталитической активности не требуются одновалентные катионы. Фермент высокоспецифичен в отношении структуры субстратов. Ни аналоги глутаминовой кислоты, ни аналоги бета-метиласпарагиновой кислоты (как, например, бета-этиласпартат) не являются субстратами мутазы.
Опыты по очистке фермента позволили установить субъединичную структуру и этого аденозилкобаламин-зависимого фермента. Были получены в гомогенном состоянии две субъединицы, которые были названы S- и Е-белками. Каждый из белков не обладал порознь активностью. Рекомбинация их и взаимодействие с коферментом приводили к восстановлению активности. Первым был очищен Е-белок. Определение молекулярного веса показало, что это довольно большой белок с мол. массой около 128 000. В отличие от ферментов, рассмотренных выше, добавление Кобаламина не защищало Е-компонент глутаматмутазы от инактивации в растворе. Е-компонент связывал 1 моль аденозилкобаламина, а в присутствии семикратного избытка S-компонента дополнительно связывал еще один моль кофермента.
Компонент S после очистки, как оказалось, обладал мол. массой 17000 и, по-видимому, содержал важные для проявления ферментативной активности SH-группы. Титрование S-белка сульфгидрильными реагентами показало, что на 1 моль белка приходится пять SH-групп. Примечательной особенностью компонента была его способность к димеризации в присутствии кислорода. Расщепление димера осуществлялось обработкой последнего каким-либо RSH-соединением. Это свидетельствовало об образовании межмолекулярного дисульфидного мостика. Инактивация S-белка с помощью AsО2 доказывала наличие в активном центре по крайней мере одной из двух вицинальных тиольных групп.
Метилмалонил-соа-мутаза
Другой аденозилкобаламин-зависимый фермент, осуществляющий перегруппировку углеродного скелета метилмалонил-СоА в сукцинил-СоА был также сначала выделен из микроорганизмов, а затем из тканей млекопитающих. Оказалось, что этот кобаламин- зависимый фермент выполняет метаболически важную роль на пути превращения пропионил-СоА в сукцинил-СоА. Схема этого участка метаболизма включает 3 фермента: биотин-зависимую карбоксилазу, рацемазу, превращающую D-метилмалонил-СоА в L-изомер и рассматриваемую кобаламин-мутазу. После очистки метилмалонил-СоА-мутазы оказалось, что это субъединичный фермент с мол. массой 124000, расщепляющийся на два компонента с мол. массой 61 000 и 63000. Выделенная из печени овцы метилмалонил-СоА-мутаза представляет собой окрашеный в оранжевый цвет белок с мол. массой 165000. Фермент связывал 1 моль аденозилкобаламин на субъединицу с мол. массой 75000.
2-метиленглутаратмутаза
Следующий сходный по действию Аденозилкобаламин-зависимый фермент-это 2-метиленглутаратмутаза, катализирующая обратимое превращение между 2-метиленглутаратом и 2-метилен-3-метилсукцинатом. Фермент был выделен из микробиологических источников при выращивании Clostridium на средах, содержащих никотиновую кислоту. Определение молекулярной массы частично очищенного препарата дало величину 170000. Обработка йодацетатом приводит к потере активности, что, очевидно, свидетельствует о наличии важных для катализа SH-групп. Действие AsO2, однако, не выявило присутствия вицинальных дитиольных групп.
Ферменты, трансформирующие альфа, омега-диаминокислоты
Еще одна группа аденозилкобаламин-зависимых ферментов бьша выявлена при исследовании микроорганизмов, растущих на L-лизине. Эти ферменты катализировали перенос NH2-группы от концевого углеродного атома в диаминокислотах к соседнему атому углерода. Недавно описан аденозилкобаламин-зависимый фермент, который осуществляет перенос NH2-группы из альфа- в бета-положение аминокислоты лейцина.
Рассмотрим более подробно аденозилкобаламин-зависимые ферменты, трансформирующие альфа, омега-диаминокислоты. Эти ферменты выделены из различных штаммов Clostridium.
Важно, что все три фермента в высшей степени специфичны для каждого из субстратов. Замена субстрата для данного фермента на субстраты других аминомутаз не позволяет осуществлять перенос аминогруппы.
D-aльфа-Лизинмутаза выделена из С. sticklandi и имеет мол. массу 250000. В процессе очистки фермента не происходило отщепления аденозилкобаламина, что свидетельствует о большой прочности связи комплекса апофермент-кофермент. Аналогично от L-бета-лизинмутазы в процессе очистки аденозилкобаламин также не отделялся. Это тетрамерный фермент с мол. массой 160000. Его субъединичная структура была подтверждена после того, как удалось выделить компоненты с мол. массой 32000 и 52000. Оказалось, что для обеспечения нормальной каталитической активности обеих мутаз необходим белок с мол. массой 60000. Как видно, аминомутазы сохраняют способность защищать в полностью реконструированном виде важные для биокатализа SH-группы. Это свойство характерно для большинства Аденозилкобаламин-ферментов.
Орнитинмутаза также представляет собой фермент с прочно связанным аденозилкобаламином, который не отщепляется при очистке. Очищенный фермент имел мол. массу 170 000 и диссоциировал на две субъединицы с мол. массой 90000. Этот фермент не требовал для своей активации какого-либо SH-белка, однако сам содержал важные для биокатализа SH-группы, вследствие чего ингибировался под действием тиоловых ингибиторов.
Заслуживает особого внимания прочность, с которой связан аденозилкобаламин во всех трех ферментах. При обработке их внутренним фактором ферменты инактивировались. Сравнительное исследование трех аминомутаз показало, что в дополнение к аденозилкобаламину для проявления их активности требуются: для D-альфа- и L-бета-мутаз ионы Mg2+ и одновалентные катионы, причем для D-aльфа-лизинмутазы -это К+, Rb+ и NH4+ (фермент ингибируется при добавлении Na+ и Li+). L-бета-лизин-мутаза в разной степени активна в присутствии Li+, Na+, К+, Rb+, Cs+ и. NH4+. Для проявления активности орнитинмутазы добавления ионов металлов вообще не требуется.
Поразительное отличие аминомутаз от всех остальных кобаламин-зависимых ферментов состоит в том, что вторым обязательным коферментом для них является пиридоксальфосфат, который обеспечивает перенос омега-NH4-группы в форме пиридоксамина или пиридоксальдимина. Очищенная орнитинмутаза неактивна до тех пор, пока к реакционной смеси не будет добавлен пиридоксальфосфат (PLP). Очевидно, что PLP входит в активный центр фермента и, по-видимому, связан в виде основания. Шиффа с эпсилон-NH4-группой остатка лизина белка.
Рибонуклеотидредуктаза
Рибонуклеотидредуктаза – фермент, катализирующий конверсию рибонуклеотидов в 2-дезоксирибонуклеотиды. Этот фермент, имеющий ключевое значение для биосинтеза ДНК у большинства живых организмов, представляет собой железо-протеиновый комплекс, не зависящий от корриноидов. Однако ряд микроорганизмов и различные Euglenophyt содержат рибонуклеотидредуктазу, коферментом которой является аденозилкобаламин. Оказалось, что фермент состоит из одной полипептидной цепи с мол. массой 76000. Субстратом для рибонуклеотидредуктазы являются рибонуклеозидтрифосфаты. Для очищенной рибонуклеотидредуктазы необходимыми кофакторами, кроме аденозилкобаламина, являются тиолы.
Автор статьи: доцент кафедры биохимии МБФ РГМУ, к.м.н. Адрианов Николай Владимирович.
Специально для ООО «Электронная Медицина».
Источник